Tres vacunas pasaron con éxito la fase 2 y la rusa “Sputnik V” va por el mismo camino
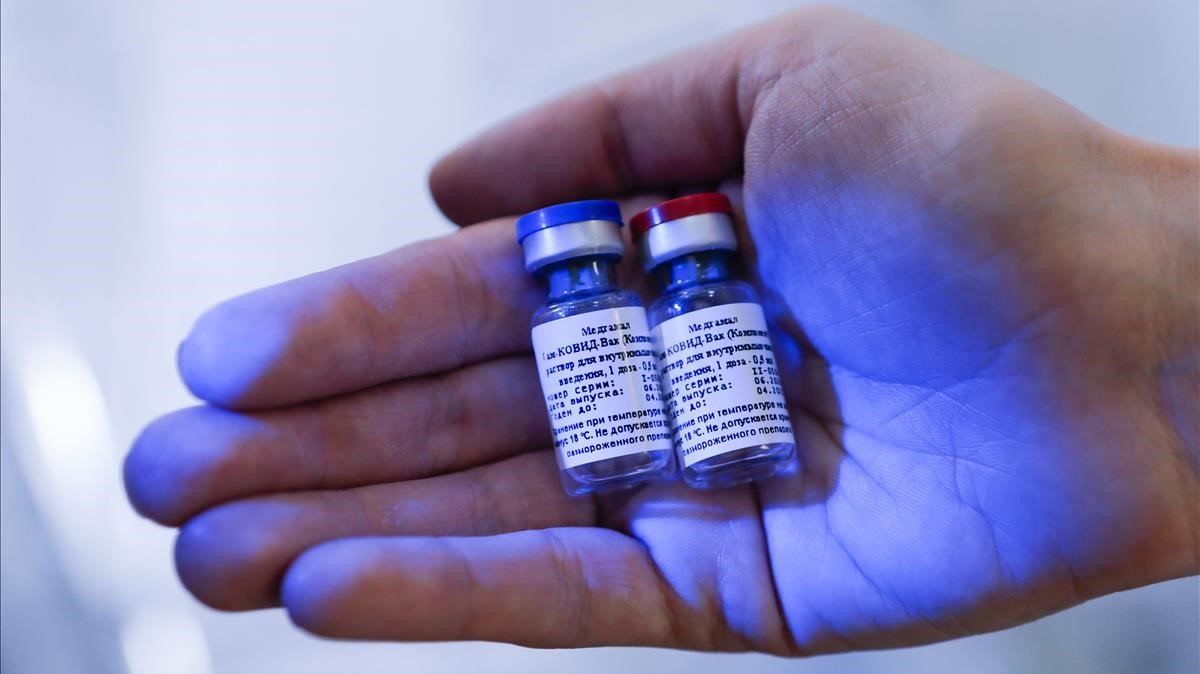
La vacuna candidata de Putin en la carrera anticovid, ‘Sputnik V’, ha comunicado los resultados de su funcionamiento en la revista científica “The Lancet”: es segura y genera anticuerpos. Mientras tanto, tres vacunas más ya pasaron la fase 2 con éxito. Aquí te contamos todo:
Actualmente hay tres vacunas en ensayos de fase 3 en Estados Unidos: la desarrollada por Moderna y el Instituto Nacional de Alergias y Enfermedades Infecciosas; la de Pfizer y BioNTech; y la de AstraZeneca y la Universidad de Oxford. Las tres ya pasaron la “fase 2” con inmunidad en voluntarios en inmunidad de tipo humoral (produce anticuerpos) y de linfocitos o células de memoria ¿Y la vacuna rusa “Sputnik V”? Ya pasó con éxito la fase 1 y los preliminares de la fase 2, según una publicación de hoy en la revista científica “The Lancet”.
La vacuna rusa se sometió al escrutinio de la ciencia con la publicación en la revista médica, donde se expone los hallazgos de la fase 1 de dos estudios clínicos en los que se probó la inmunización. También superó con éxito los resultados preliminares de eficacia obtenidos en una fase 2. La vacuna se muestra segura y produce respuesta inmune, medida tanto en la aparición de anticuerpos como en la inmunidad celular.
La vacuna que se presentó con el nombre de Sputnik V implica dos inyecciones (inducción y refuerzo) que utilizan dos vectores de virus causantes del resfriado común, que se debilitan para que no puedan causar enfermedad. En concreto, son el adenovirus humano recombinante tipo 26 (rAd26-S) y el adenovirus humano recombinante tipo 5 (rAd5-S), ambos modificados para expresar la proteína S del coronavirus SARS-CoV-2. Al emplear dos tipos de vectores adenovirales diferentes en la primera y segunda dosis se busca evitar que el sistema inmune reaccione frente al primer vector y comprometa así la respuesta inmune.
Así lo explica el investigador principal, Denis Logunov, del Centro Nacional de Investigación de Epidemiología y Microbiología Gamaleya, en Moscú: “Cuando las vacunas de adenovirus entran en las células humanas, entregan el código genético de la proteína ‘spike’ del SARS-CoV-2, que hace que las células produzcan la proteína. Esto ayuda a enseñar al sistema inmunológico a reconocer y atacar el virus SARS-CoV-2. Para obtener una respuesta inmunitaria potente contra el SARS-CoV-2, es importante que se proporcione una dosis de refuerzo. Sin embargo, las vacunas de refuerzo que utilizan el mismo vector de adenovirus pueden no producir una respuesta eficaz, porque el sistema inmunológico puede reconocer y atacar al vector. Eso bloquearía la entrada de la vacuna en las células de las personas y mostraría al organismo cómo reconocer y atacar el SARS-CoV-2. Para nuestra vacuna, utilizamos dos vectores de adenovirus diferentes en un intento de evitar que el sistema inmunológico se vuelva inmune al vector”, detalla el especialista.
Según detallan los estudios publicados, la vacuna se probó en 76 voluntarios en dos hospitales de Rusia. Los ensayos fueron abiertos y no aleatorizados, lo que significa que los participantes sabían que estaban recibiendo la vacuna y no fueron asignados al azar a diferentes grupos de tratamiento. En los ensayos participaron adultos sanos de entre 18 y 60 años, que se aislaron en un hospital durante los primeros 28 días, para vigilar de forma intensiva posibles efectos adversos. En la fase 1 de cada ensayo, los participantes recibieron el primero de los componentes de la vacuna, y en la fase 2, que comenzó no antes de cinco días después de que comenzara el ensayo de la fase 1, los participantes recibieron la vacuna completa de dos partes (primero el componente rAd26-S, seguida de una vacuna de refuerzo con rAd5 -S en el día 21).
La vacuna resultó segura y se toleró bien, durante el período de estudio de 42 días, sin llegar a detectarse efectos graves. Los eventos adversos más comunes, y que se han referido en vacunas similares, fueron dolor en el lugar de la inyección, fiebre, dolor de cabeza, fatiga y dolores musculares y articulares. El ensayo en fase 3 se aprobó el 26 de agosto y tiene previsto incluir a 40,000 voluntarios de diferentes edades y grupos de riesgo.